后肾腺瘤
Metanephric Adenoma
概述:
后肾腺瘤是由高度富于细胞、小而一致的胚胎样细胞组成的良性肾肿瘤。
发病部位: 肾脏
诊断要点:
少见,发病年龄宽广,从婴幼儿到老年人均可发生。在成人,后肾腺瘤中位发病年龄约 50 岁,大多数发生于 50 ~ 60 岁之间,女性好发,男女比约为 1:2。在儿童,后肾腺瘤是最常见的肾脏原发的上皮性肿瘤。
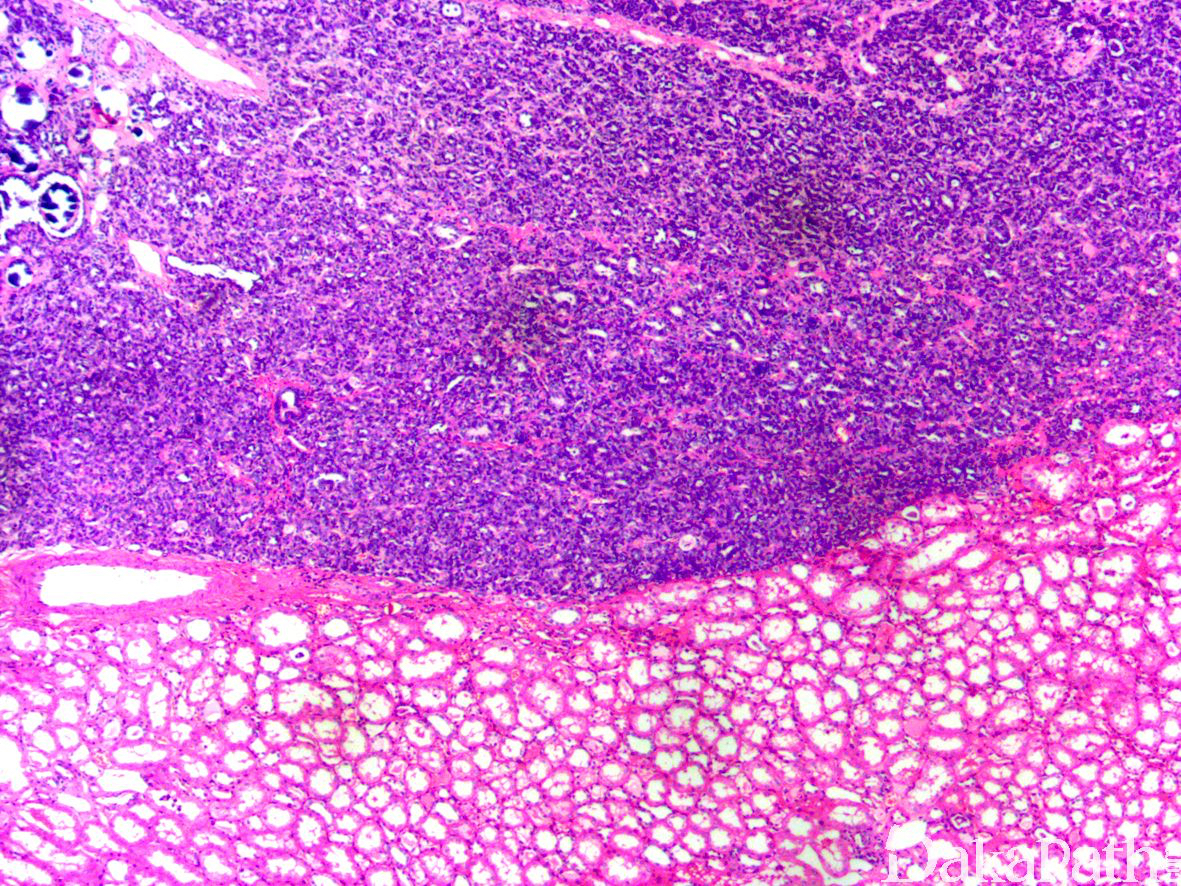
通常单侧发生,大体上界限清楚,直接与肾组织毗邻,偶尔可见薄而不连续的纤维性假包膜。瘤体最大直径通常 3 ~ 6cm,偶尔可达 15cm。切面实性灰黄色,质软或实,常见钙化;可见出血,较大的肿瘤可见局灶性梗死;约 10%可见不同程度的囊性变,偶尔肿瘤可完全为囊性。
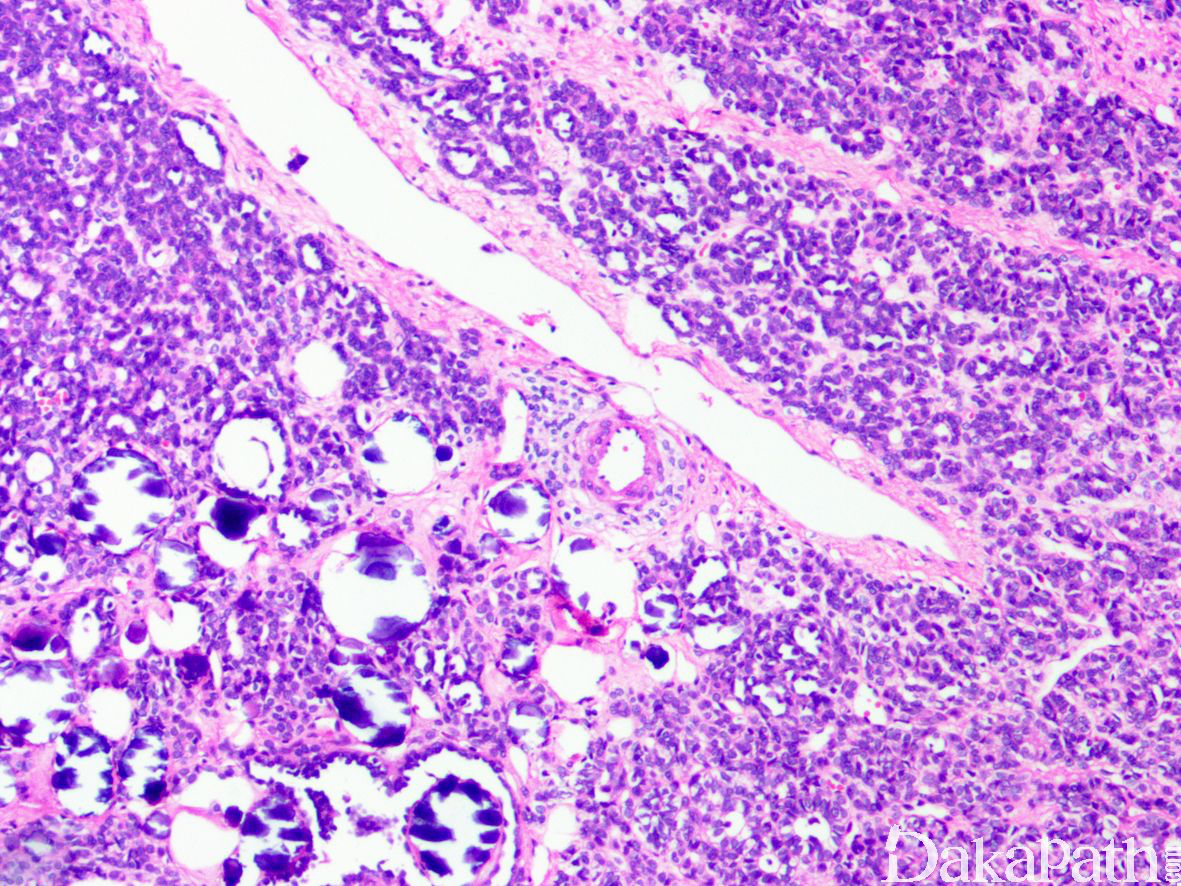
镜下无包膜,直接与周围肾组织毗邻。肿瘤由致密排列的小而一致的腺泡或小管组成,腺泡和小管的腔隙狭窄或紧闭使得肿瘤在低倍镜下呈现一种高度富于细胞的实性小蓝圆细胞组织学假象。
病变内常见伸展的狭长或分支的小管,半数左右的后肾腺瘤可见不同比例的乳头状结构,乳头通常较小而顿挫,常见表现为轻度扩张的小管或腺泡内附壁的乳头状增生,类似于不成熟的肾小球样结构,乳头中央常见沙砾体形成。
瘤细胞呈小立方状,大小较一致,仅比成熟的淋巴细胞略大,胞浆稀少,核圆形或卵圆形,核染色质纤细,核仁不明显,核分裂象罕见或缺如。
肿瘤间质多少不等,疏松至水肿状,血管结构不明显,10-20%的肿瘤内可见间质透明瘢痕、微囊形成或局灶的钙化、骨化等。



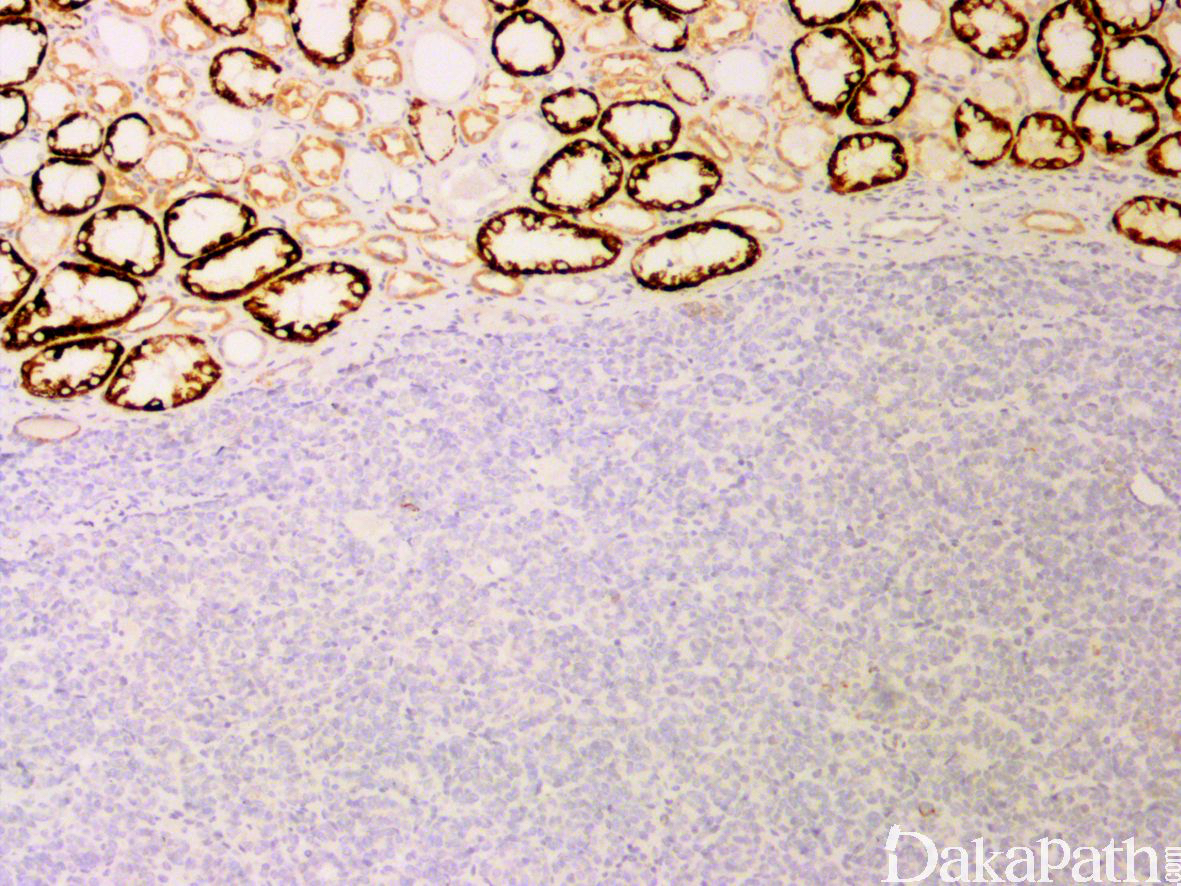
免疫组织化学染色:
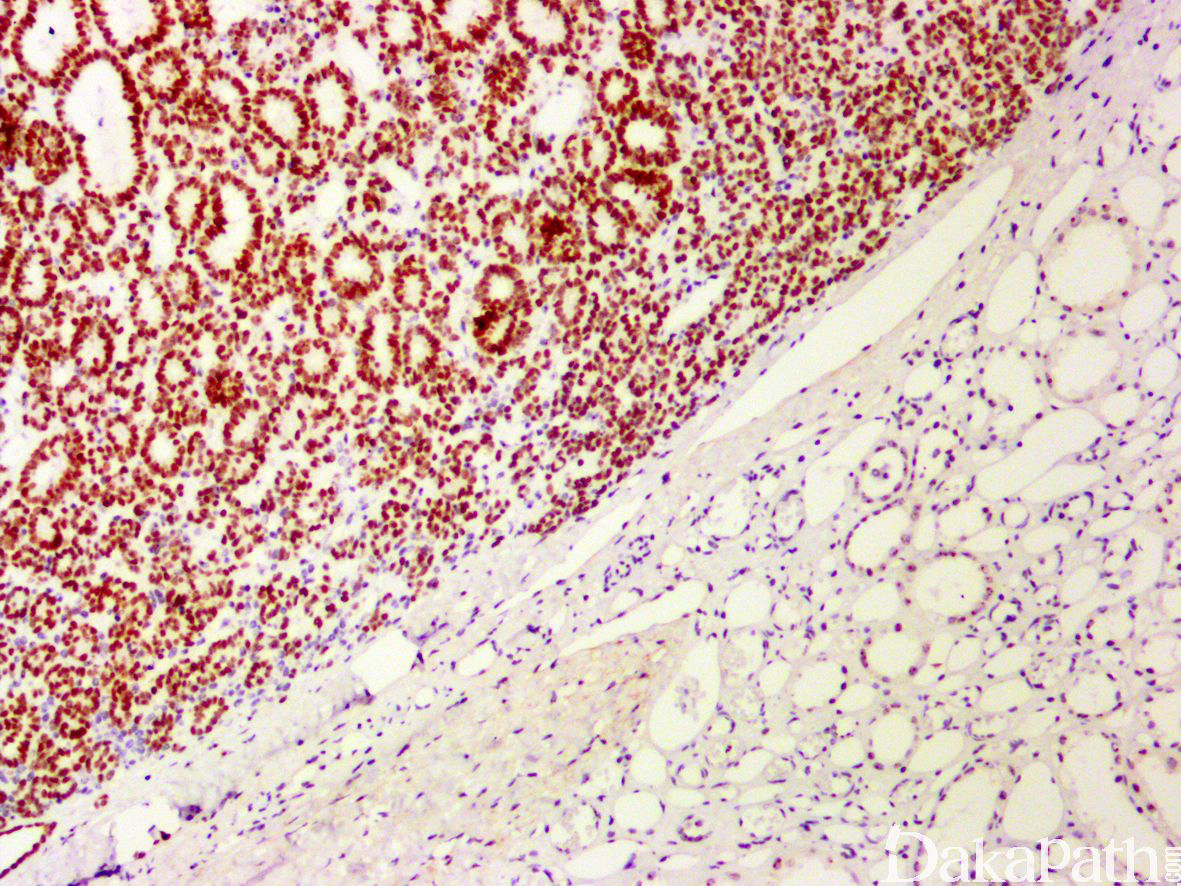
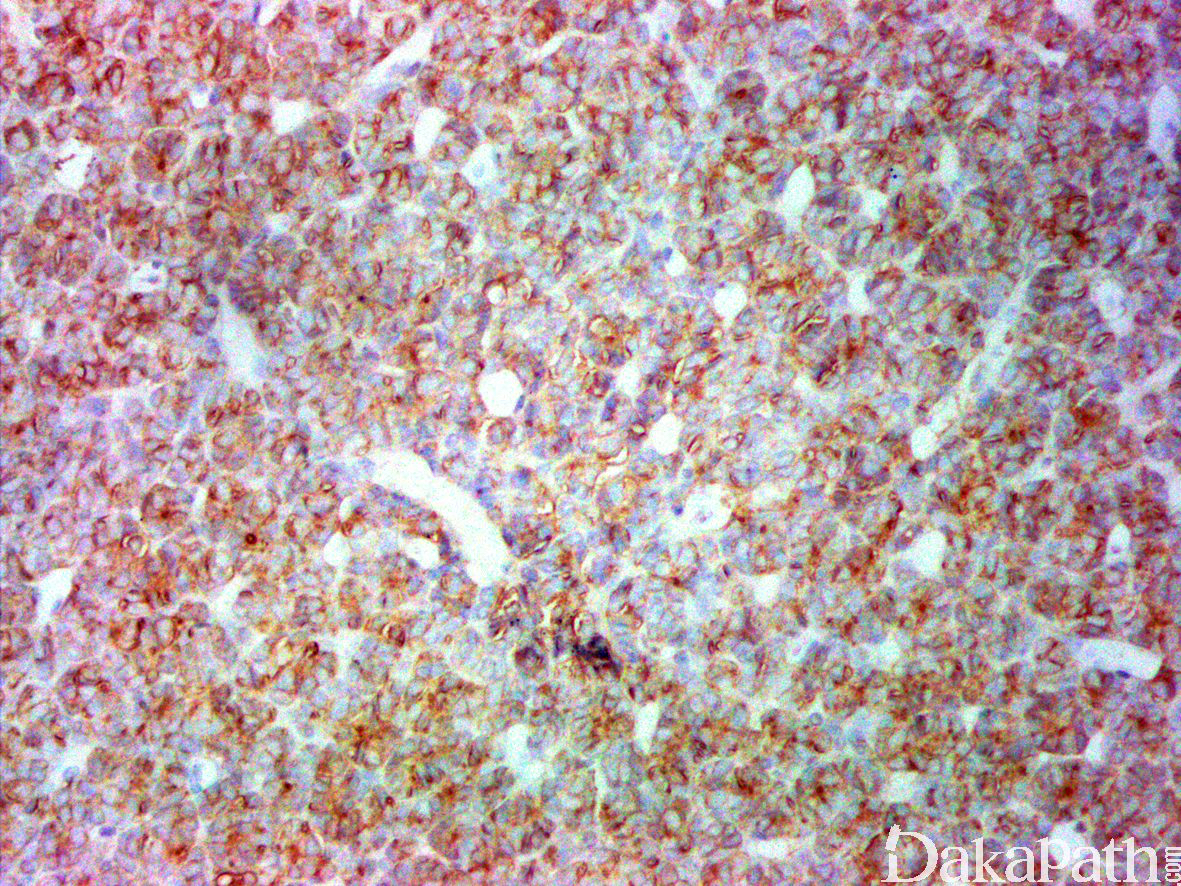
漫核表达 WT1,大多数表达 CD57 和 Cadherin 17,部分可表达 CK(包括广谱 CK、Cam5.2 以及 CK18 等)和波形蛋白,不表达或仅仅局灶表达 CK7,阳性通常局限于伸展而狭长的小管。通常不表达 AMACR/P504s、上皮膜抗原(EMA)以及结蛋白等标志物。
分子标记:
约 90%的后肾腺瘤存在 BRAF 基因的 V600E 突变,免疫组化染色表达 BRAF V600E 特异性抗体 VE1
鉴别诊断:
上皮细胞为主性肾母细胞瘤: 与后肾腺瘤不同,上皮细胞为主性肾母细胞瘤的小管或腺泡的被覆上皮呈矮柱状垂直于基底膜分布,核异型性更明显,核染色质较粗糙,核分裂象较多见,仔细观察常见局灶的胚基或间叶性肿瘤成分。免疫组化染色,上皮细胞为主性肾母细胞瘤通常不表达 Cadherin 17,较少表达 CD57,遗传学上无 BRAF 基因的 V600E 突变,可资鉴别。
实性乳头状肾细胞癌 :与后肾腺瘤不同,实性乳头状肾细胞癌的瘤细胞胞浆较丰富,核较大,局灶常见发育更充分的乳头状结构(有纤维血管轴心),间质内常见泡沫样细胞和含铁血黄素沉积。免疫组化染色,乳头状肾细胞癌通常弥漫表达 EMA、CK7 和 AMACR,不表达 Cadherin 17. WT1 和 CD57, 遗传学上特征性的表现为 7 号和 17 号染色体三体和 Y 染色体丢失,无 BRAF 基因的 V600E 突变。
肾脏神经内分泌肿瘤/类癌 :与后肾腺瘤不同,肾脏类癌常见缎带和梁状排列,间质血窦丰富,核分裂象常见,免疫组化染色表达神经内分泌标志物(CgA、Syn 和 CD56 等),不表达 WT1。
预后:
良性肾肿瘤,偶尔肿瘤可累及至肾门淋巴结,这一表现认为是肿瘤局限性种植而非转移性扩散所致。
治疗:
切除
病例报道:
ACaseofMetanephric Adenomaand Acute Myocardial Infarction.
参考文献:
[1] Moch H, Humphrey P A, Ulbright T M, et al. WHO Classification of Tumours of the Urinary System and Male Genital Organ [M]. Lyon: IARC, 2016. [2] Udager A, Pan J, Magers MJ, et al. Molecular and immunohistochemical characterization reveals novel BRAF mutations in metanephric adenoma [J]. Am J Surg Pathol, 2015, 39 (4): 549–557. [3] Yakirevich E, Magi-Galluzzi C, Grada Z, et al. Cadherin 17 is a sensitive and specific marker for metanephric adenoma [J]. Am J Surg Pathol, 2015, 39(4):479-86.
← 肾混合性上皮和间质肿瘤 后肾间质肿瘤 →
