骨髓增生异常综合征 – 概论
Myelodysplastic Syndromes - Introduction
概述:
骨髓增生异常综合征是一组克隆性造血干细胞疾病,表现为一系或多系外周血细胞减少、一系或多系骨髓造血细胞异型增生、无效造血及有部分病例进展为急性髓系白血病。 2017 年 WHO 淋巴造血系统肿瘤分类第四版更新版(2016 版)正式出版了,在骨髓增生异常综合征(MDS)的分类(表 1)、诊断标准(表 2)及预后相关因素方面进行了部分更新: 1)2016 版去除 2008 年分类术语中的“难治性血细胞减少”及“难治性贫血”,而冠以“骨髓增生异常综合征”; 2)骨髓增生异常综合征伴单系异型增生不再细分; 3)骨髓增生异常综合征伴环形铁粒幼细胞(MDS-RS),新版本根据异型增生系别的多少分为两个亚型:MDS-RS-SLD、MDS-RS-MLD; 4)骨髓增生异常综合征伴原始细胞增多(MDS-EB),增加了一个亚型:MDS-EB-EP,该型部分病例隶属于 2008 年版本急性红白血病。
诊断要点:
- 多见于老年,中位发病年龄 70 岁。表现为外周血细胞减少,包括贫血、白细胞和血小板减少。
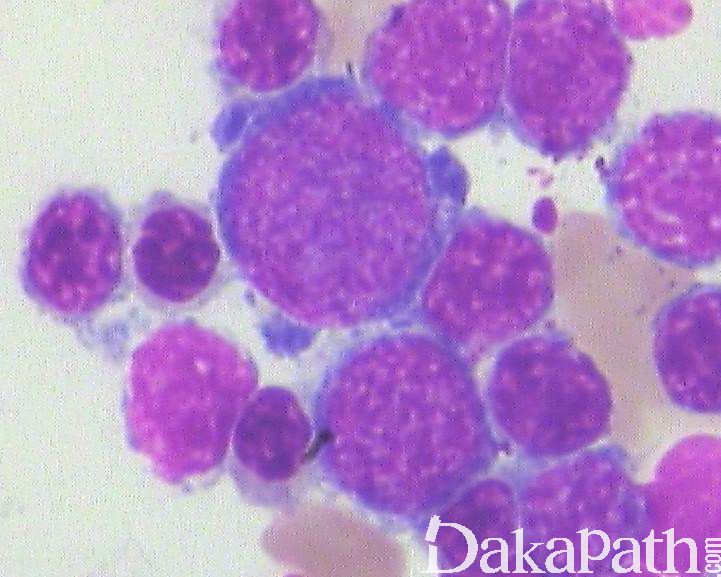
- 细胞形态学:细胞形态学证据主要根据骨髓原始细胞计数值、异型增生细胞的种类和程度及是否存在环形铁粒幼细胞。原始细胞计数<20%(其范围可以从正常到 19%),异型增生细胞(表 3)至少达该系的 10%,环形铁粒幼红细胞至少达有核红细胞的 15%(有 SF3B1 突变例外)。外周血细胞也可见异型并可有循环原始细胞。
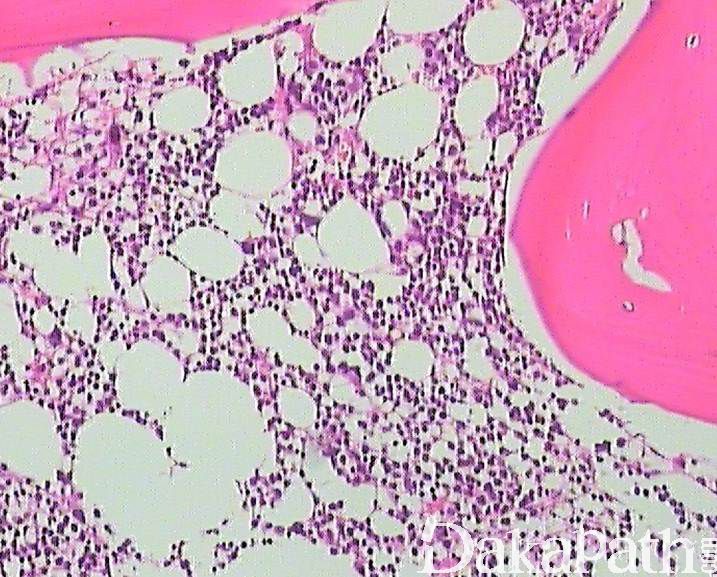
- 骨髓活检:细胞密度通常增高 或正常(少数减低),巨核细胞异型性常更明显,原始细胞可以正常或不同程度增高(<20%)。
免疫学:免疫组化和流式可检测母细胞量及抗原表达,流式分析骨髓前体细胞成熟过程中的抗原表达模式有也助诊断。
髓系成熟异常:粒系 CD16. CD15 表达不同步;CD13/CD11b,CD13/CD16 表达模式改变,异常表达 CD56. CD7,SSC 信号减弱;
单核:异常表达 CD56. CD7;
红系前体细胞:CD71 和/或 CD36 表达减弱,异常表达 CD56. CD7;
骨髓有核细胞中 CD34 阳性细胞>2%预后不良因素;
注:(1)最少 3 项异常表现且最少累及两系才与 MDS 或 MDS/MPN 高度相关;
(2)只是 MDS 的支持证据,不能单独作为初发 MDS 诊断,其报告必须和骨髓形态学及遗传学结果整合在一起。
(3)需根据新出版的指南选择抗体组合,同时抗体组合特异性需要验证。
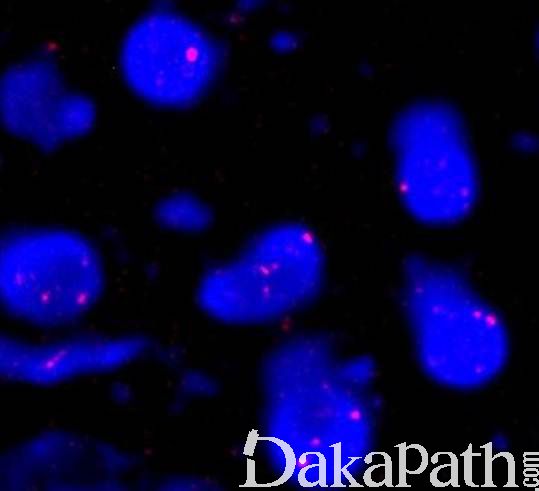
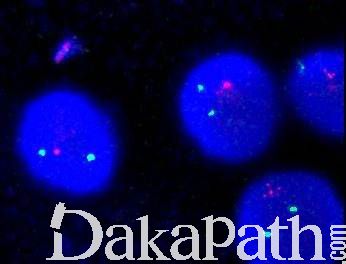
- 遗传学:约 50%骨髓增生异常综合征病例有克隆性遗传学异常(见表 4)。此外,80-90% MDS 患者有体细胞基因突变,已经明确的基因突变有 50 种以上(表 5),最常见的有:SF3B1, TET2, SRSF2, ASXL1, DNMT3A, RUNX1, U2AF1, TP53, and EZH2, 但这些突变不是 MDS 所特有的, 其它髓系肿瘤甚至正常年长者也可见到,因此它们的存在不能作为确诊 MDS 的证据(见鉴别诊断)。
骨髓增生异常综合征最低诊断标准:
持续不明原因外周血细胞减少(一系或多系, >6 个月)(WHO:血红蛋白<10 g/dL,血小板<100 x 109/L,中性粒细胞计数<1.8 x 109/L)。
同时至少符合下列其中一项:
(1)形态学异型细胞占该系有核细胞至少 10%(巨核系 40%特异性更高)
(2)环形铁粒幼红细胞占有核红细胞至少 15%(如有 SF3B1 突变,达 5%即可)
(3)获得性持续性克隆性染色体异常(与原发 AML 相关的重现性异常除外)
(4)原始细胞至少 5% (<20%)。
诊断 MDS 注意事项
临床病史及用药史不详的病例不要诊断 MDS;
用细胞因子治疗的病人不要诊断 MDS 或对已知 MDS 病例重新分类;
感染、药物、免疫异常、营养不良、重金属中毒、铜缺乏都可能引起细胞减少和异型增生;
原因不明的持续血细胞减少没有异型增生的除非有 MDS 特征性细胞遗传学异常不诊断 MDS;
原因不明的持续血细胞减少没有异型增生或 MDS 特征性细胞遗传学异常可诊断为原发性血细胞减少,应检测血液学及遗传学指标;
具 MDS 相关克隆性体细胞基因突变(无 MDS 相关的细胞遗传学异常,表 4. 表 5),即使有血细胞减少,但骨髓无异型增生时也不能诊断 MDS,应诊断为克隆性血细胞增生意义不明(clonal hematopoiesis with indeterminate potential)。
附表
表 1 2008 年与 2016 年 WHO 骨髓增生异常综合征分类比较
2008年WHO分类 | 2016年WHO分类 |
难治性血细胞减少伴单系发育异常 难治性贫血 难治性中性粒细胞减少 难治性血小板减少 | 骨髓增生异常综合征伴单系异型增生 |
难治性贫血伴环形铁粒幼细胞 | 骨髓增生异常综合征伴环形铁粒幼细胞及单系异型增生 骨髓增生异常综合征伴环形铁粒幼细胞及多系异型增生 |
难治性血细胞减少伴多系发育异常 | 骨髓增生异常综合征伴多系异型增生 |
难治性贫血伴原始细胞增多 RAEB-1 RAEB-2 | 骨髓增生异常综合征伴原始细胞增多 MDS-EB-1 MDS-EB-2 骨髓增生异常综合征伴原始细胞增多及红系优势增生 骨髓增生异常综合征伴原始细胞增多及纤维化 |
骨髓增生异常综合征伴孤立性5q- | 骨髓增生异常综合征伴孤立性5q- |
骨髓增生异常综合征,不能分类 | 骨髓增生异常综合征,不能分类 |
暂定类型:幼年性难治性血细胞减少 | 暂定类型:幼年性难治性血细胞减少 |
表 2 各型骨髓增生异常综合征的诊断标准
分类 | 异型增生系别数 | 细胞减少系别数 | 环形铁粒幼细胞比例 | 骨髓/外周血母细胞 | 染色体核型分析 |
MDS-SLD | 1 | 1-2 | <15%/<5% | BM<5% PB<1% 无Auer小体 | 任何形式,但不满足MDS-5q-诊断 |
MDS-MLD | 2-3 | 1-3 | <15%/<5% | BM<5% PB<1% 无Auer小体 | 任何形式,但不满足MDS-5q-诊断 |
MDS-RS-SLD | 1 | 1-2 | ≥15%/≥5% | BM<5% PB<1% 无Auer小体 | 任何形式,但不满足MDS-5q-诊断 |
MDS-RS-MLD | 2-3 | 1-3 | ≥15%/≥5% | BM<5% PB<1% 无Auer小体 | 任何形式,但不满足MDS-5q-诊断 |
MDS 5q- | 1-3 | 1-2 | 无/任何 | BM<5% PB<1% 无Auer小体 | 5q-单一或伴另1个异常(不包括-7/-7q) |
MDS-EB-1 | 1-3 | 1-3 | 无/任何 | BM5-9%或PB2-4% BM<10%且PB<5% 无Auer小体 | 任何 |
MDS-EB-2 | 1-3 | 1-3 | 无/任何 | BM10-19%/PB5-19% 或Auer小体,BM和PB<20% | 任何 |
MDS-U 1%外周血母细胞 | 1-3 | 1-3 | 无/任何 | BM<5% PB=1% 无Auer小体 | 任何 |
MDS-U伴SLD及全血细胞减少 | 1 | 3 | 无/任何 | BM<5% PB<1% 无Auer小体 | 任何 |
MDS-U基于诊断性细胞遗传学异常 | 0 | 1-3 | <15% | BM<5% PB<1% 无Auer小体 | MDS特征性细胞遗传学异常 |
注:1. 幼稚细胞计数要求:骨髓涂片或印片 计数 500 细胞;外周血 200 细胞。骨髓髓系肿瘤幼稚细胞比例为幼稚细胞占所有有核细胞的比例,外周血则排除有核红细胞。2. 异型增生判断要求:红系前体细胞观察 200 个,粒系及其前体细胞 200 个,巨核细胞最少 30 个,推荐免疫组化,如 CD61 显示小巨核细胞。3. 有 13%的 MDS 患者外周血幼稚细胞比例比骨髓高,预后差。
表 3 骨髓增生异常综合征的细胞异型形态学特征
红系 | 粒系 | 巨核细胞 |
核间桥 核出芽 核固缩 多核或核分叶 巨幼细胞改变 环形铁粒幼细胞 空泡状胞质 PAS阳性胞质 | 体积小或增大 核分叶减少(假Pelger-Huet) 核分叶过多 颗粒减少 假Chediak-Higashi颗粒 Dohle小体 Auer小体 | 小巨核细胞 多核巨核细胞 核不分叶 |
注:单纯巨幼变不能确定红系异型增生;异烟肼治疗在维生素 B6 补充不足时可引起环形铁粒幼细胞;Auer 小体与原始细胞增多相关,原始细胞<5%的病例很少见到 Auer 小体;小巨核细胞及多个大小一致圆形核巨核细胞诊断价值更大。
表 4 骨髓增生异常综合征的重现性细胞遗传学改变
染色体异常 | 总发生率 | 治疗相关MDS发生率 |
非平衡异常(获得或缺失) +8* -7, 7q- 5q- 20q-* -Y* i(17q), t(17p) -13, 13q- 11q- 12p-, t(12p) 9q- Idic(X)(q13) | 10% 10% 10% 5-8% 5% 3-5% 3% 13% 3% 1-2% 1-2% | 50% 40% 25-30% |
体平衡异常(易位或倒置): t(11;16)(q23.3;p13.3) t(3;21)(q26.2;q22.1) t(1;3)(p36.3;q21.2) t(2;11)(p21;q23.3) inv(3)(q21.3;q26.2)/t(3;3)(q21;q26.2) t(6;9)(p23;q34.1) | 1% 1% 1% 1% | 3% 2% |
注:标记的染色体异常在缺乏形态学证据的情况下不能单独作为 MDS 诊断的确定性依据,表中其它染色体异常即使没有明确的形态学证据对于原因不明的持续血细胞减少患者也可作为 MDS 的诊断依据。
表 5 骨髓增生异常综合征的常见体细胞基因突变
突变基因 | 发生率 | 预后意义 | 备注 |
SF3B1 | 20-30% | 预后好 | 可见于健康人群 |
TET2 | 20-30% | 不确定 | 可见于健康人群 |
ASXL | 15-20% | 预后差 | 可见于健康人群 |
SRSF2 | ~15% | 预后差 | 可见于健康人群 |
DNMT3A | ~10% | 预后差 | 可见于健康人群 |
RUNX1 | ~10% | 预后差 | |
U2AF1 | 5-10% | 预后差 | 可见于健康人群 |
TP53 | 5-10% | 预后差 | 可见于健康人群 |
EZH2 | 5-10% | 预后差 | |
ZRSR2 | 5-10% | 不确定 | |
STAG2 | 5-7% | 预后差 | |
IDH1/IDH2 | ~5% | 不确定 | |
CBL | ~5% | 预后差 | 可见于健康人群 |
NRAS | ~5% | 预后差 | |
BCOR | ~5% | 预后差 | 可见于健康人群 |
表 6 骨髓增生异常综合征细胞遗传学积分系统(CCSS)
预后分组 | 细胞遗传学异常 |
很好(very good) | -Y,-11q |
好(good) | 正常核型、-5q,-12p,-20q,含-5q的双异常 |
中(intermediate) | -7q,+8,+19,i(17q),其它1或2个非特指异常,2个或更多独立非复合性克隆 |
差(poor) | -7,inv(3)/t(3q)/-3q,含-7q或-7的双异常,3个复杂异常 |
很差(very poor) | >3个的复杂异常 |
表 7 2012 年版 IPSS-R 评分标准
预后因素 | 0分 | 0.5分 | 1.0分 | 1.5分 | 2分 | 3分 | 4分 |
细胞遗传 | 很好 | — | 好 | — | 中 | 差 | 很差 |
骨髓母细胞% | ≤2 | — | >2~<5 | — | 5~10 | >10 | — |
血红蛋白 | ≥10 | — | 8~<10 | <8 | — | — | — |
血小板 | ≥100 | 50~<100 | <50 | — | — | — | — |
中性粒细胞计数 | ≥0.8 | <0.8 | — | — | — | — | — |
表 8 2012 年 IPSS-R 危险度分级
危险度 | 危险度积分 |
很低(very low) | ≤1.5 |
低(low) | >1.5~3 |
中(intermediate) | >3~4.5 |
高(high) | >4.5~6 |
很高(very high) | >6 |
鉴别诊断:
反应性改变: MDS 的形态学异常不具有特异性,类似改变可见于(但不限于)下列情况:
维生素 B12 和叶酸缺乏、药/毒物、自身免疫性疾病、感染等;
必需元素(essential element)缺乏;
重金属暴露(砷、铅、中毒剂量的锌);
一些药物及生物制剂治疗(异烟肼治疗在维生素 B6 补充不足时可引起环形铁粒幼细胞);
抗生素磺胺甲基异恶唑、免疫抑制剂他克莫司和霉酚酸酯可引起明显粒细胞分叶减少;
病毒感染(如 B19 病毒)、铜缺乏、化疗等均可引起异型改变;
细胞因子(粒细胞集落形成因子)可引起粒系核左移及异型增生;
自身免疫性疾病也可伴 MDS 样改变。
- 先天性异常:如先天性铁粒幼红细胞贫血。
- 再生障碍性贫血:注意和低增生性骨髓增生异常综合征相鉴别。
- 原发性骨髓纤维化或急性全髓增殖症伴骨髓纤维化:形态学可与骨髓增生异常综合征特别是高级别骨髓增生异常综合征伴纤维化类似,需结合病史,临床表现和遗传学作综合判断。
- 化疗导致的细胞异型和细胞减少:可分两种情况,近期化疗引起的一过性“反应性”改变和有远期化疗病史的克隆性异常(治疗相关 MDS)。
- 急性髓系白血病伴重现性遗传学异常:部分病例原始细胞少于 20%,需与骨髓增生异常综合征伴原始细胞增高相鉴别。
- 意义不明的原发性细胞减少(Idiopathic Cytopenia of Unknown Significance – ICUS):持续不明原因外周一系或多系细胞减少,无细胞发育异常,无染色体异常。
- 意义不明的原发性异型增生(Idiopathic Dysplasia of Unknown Significance - IDCUS):单系或多系明显(>10%)异型增生,但无外周血细胞减少。
- 意义未定的克隆性细胞减少(Clonal Cytopenia of Undetermined Significance – CCUS):意义不明的原发性细胞减少(ICUS)伴有体细胞基因突变(但无异型增生)。
- 意义不确定的克隆性造血(Clonal Hematopoiesis of Indeterminate Significance – CHIP):约 10%的 65 岁以上正常(无细胞减少,无异型增生)老年人存在体细胞基因突变,这部分人患血液系统肿瘤的风险增高。
